Εικόνα#1: Κυριότερα μονοατομικά ιόντα:
Εικόνα#2: Κυριότερα πολυατομικά ιόντα:

Εικόνα#3: Συνηθέστεροι αριθμοί οξείδωσης:

Ο αριθμός οξείδωσης (συντομογραφία "α.ο.") είναι μια συμβατική χημική έννοια που επινοήθηκε για να διευκολύνει εκτός των άλλων:
- Τη γραφή των χημικών τύπων και την ονοματολογία των χημικών ενώσεων.
- Τη μελέτη των διαφόρων ενώσεων του κάθε χημικού στοιχείου.
Παραδείγματα:
- Στο φθοριούχο ασβέστιο (CaF
2) που αποτελείται από ιόντα Ca
2+ και F
−,
το ασβέστιο έχει α.ο. = +2 και το φθόριο α.ο. = −1.

- Στο μεθάνιο,
που φαίνεται στην επάνω εικόνα, αν θεωρηθεί ότι τα τέσσερα κοινά ζεύγη
ηλεκτρονίων ανήκουν εξ ολοκλήρου στο ηλεκτραρνητικότερο άτομο μεταξύ άνθρακα (C) και υδρογόνων
(Η) που είναι ο C, τότε αυτός αποκτά "φαινομενικό φορτίο" −4, ενώ κάθε
άτομο Η αποκτά +1. Άρα λέμε ότι στο μεθάνιο ο α.ο. του C είναι −4 και
καθε ατόμου Η είναι +1.
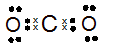
Ανάλογα θεωρούμε ότι στο διοξείδιο του άνθρακα (CO 2), της επάνω εικόνας, τα κοινά ζεύγη ηλεκτρονίων ανήκουν στο οξυγόνο (Ο) που είναι ηλεκτραρνητικότερο του άνθρακα (C). Άρα α.ο. Ο = −2 και α.ο. C = +4.
- Όταν συνδέονται ομοιοπολικά όμοια άτομα (π.χ στο μόριο του οξυγόνου, Ο 2), δεχόμαστε ότι ο α.ο. κάθε ατόμου είναι μηδέν γιατί δεν υπάρχει διαφορά ηλεκτραρνητικότητας και τα κοινά ζεύγη ηλεκτρονίων ανήκουν και στα δύο άτομα.

